快讯
医美行业观察

I类医用敷料“缓刑期”结束,行业肃清后的“真面目”是什么?
医美行业观察导读:
随着皮肤护理产品制造工业的革新,以及消费者对高品质产品的需求,使用专业皮肤护理产品逐渐成为市场新趋势。而基于安全和功效双重需求近年来,皮肤修复及护肤概念开始盛行,医用敷料产品凭借适用性广、安全性高及功效性强等优势备受消费者青睐。随之而来的市场乱象又成为阻碍行业发展的不良因素,但值得欣喜的是行业监管在向前推进。
2022年3月24日,NMPA对外发布《关于调整《医疗器械分类目录》部分内容的公告(2022年第25号) 》(以下简称《公告》)。 据悉,《公告》中称,对于由I类调整为Ⅱ类管理的“14-10-08液体敷料、膏状敷料”中非无菌提供、通过在创面表面形成保护层,起物理屏障作用,用于小创口、擦伤、切割伤等浅表性创面及周围皮肤的护理的液体敷料、膏状敷料类产品,自本公告发布之日起,可按《医疗器械注册与备案管理办法》(国家市场监督管理总局令第47号)的规定申请注册。 2022年1月1日前已按照2017版《医疗器械分类目录》办理第一类医疗器械产品备案的,2023年4月1日前产品备案继续有效;自2023年4月1日起,该类产品未依法取得医疗器械注册证不得生产、进口和销售。 所以到今年4月1日起,I类医用敷料的“缓刑期”将结束,医用敷料最低也要获得Ⅱ类审批。 《公告》称,自2023年4月1日起,生产、销售未依法取得医疗器械注册证的液体敷料、膏状敷料类产品,将依据《医疗器械监督管理条例》第八十一条的规定,由负责药品监督管理的部门没收违法所得、违法生产经营的医疗器械和用于违法生产经营的工具、设备、原材料等物品;违法生产经营的医疗器械货值金额不足1万元的,并处5万元以上15万元以下罚款;货值金额1万元以上的,并处货值金额15倍以上30倍以下罚款;情节严重的,责令停产停业,10年内不受理相关责任人以及单位提出的医疗器械许可申请,对违法单位的法定代表人、主要负责人、直接负责的主管人员和其他责任人员,没收违法行为发生期间自本单位所获收入,并处所获收入30%以上3倍以下罚款,终身禁止其从事医疗器械生产经营活动。 医用敷料的管理一直是行业热议的话题。 从定义上来看,医用敷料是一种常见的医疗器械,在医疗卫生领域起着重要的作用,已得到广泛应用。它主要用于清洁覆盖创面、吸收体内渗出液、为创面提供愈合环境,有些医用敷料还可用于手术过程中支撑器官或组织。 2019年,国家卫生健康委员会官网发布了医疗器械安全管理的行业标准,根据医疗器械风险程度进行了详细划分,分为低风险、中风险和高风险,也就是《医疗器械监督管理条例》(以下简称《管理条例》)中的一类、二类和三类。 其中,一类医疗器械的管理较为宽松,常规控制即可;二类医疗器械则需要特殊控制;三类医疗器械存在较高潜在风险,必须严格控制。 此前,很多化妆品企业利用一类医疗器械相对宽松的监管,以“医用冷敷贴”的名义申请了大量的一类医疗器械证号,并以“械字号面膜”的名义进行产品宣传和销售。但这股风潮很快被监管部门叫停。 国家药监局先是在2020年初明确提出:“不存在‘械字号面膜’的概念,医疗器械产品也不能以‘面膜’作为其名称。紧接着在2022年初修订的《第一类医疗器械产品目录》中,将医用冷敷贴直接从目录中进行了剔除,并要求相关产品在2022年4月1日前完成备案信息变更。 至此,只剩持有二类和三类医疗器械证号的“医用敷料”,被允许在医美或者微整形后使用。 一、二、三类之间的审批流程和难度相差很多,根据《管理条例》与《医疗器械注册与备案管理办法》,第一类医疗器械实行产品备案管理,备案人向设区的市级负责药品监督管理的部门提交备案资料即可办理;而二、三类医疗器械需要进行产品注册管理,其中二类医疗器械由省、自治区、直辖市药品监督管理部门进行审查,而三类则由国家药品监督管理局审查,经各自部门批准后才发给医疗器械注册证。 纳入II类医疗器械管理的产品共计12款,其中10款为医用敷料产品。其中,经常被用于激光/光子/果酸换肤/微整形手术后护理的“医用海藻糖创面敷料”也在其中。
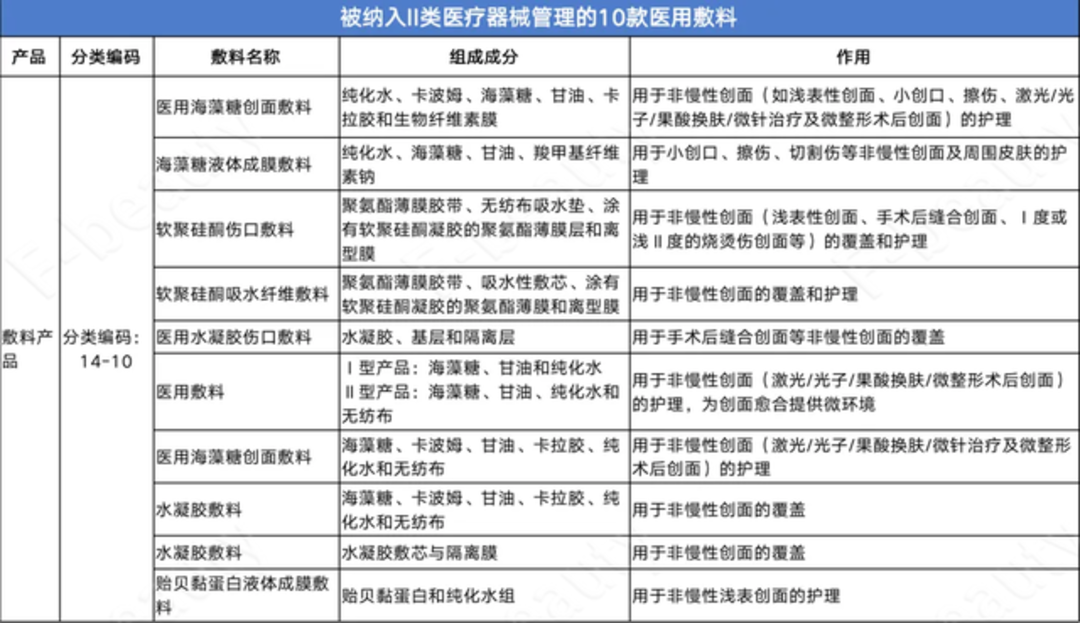
有媒体称,用于激光、光子术后浅表创面和浅表非慢性创面护理的“医用胶原蛋白敷料”被列入了III类医疗器械管理,但在组成成分中注明了该“胶原蛋白”指的是“动物源性原料”。这意味着,动物源胶原蛋白敷料被正式纳入III类医疗器械管理。当下最热门的利用合成生物技术生产的“重组胶原蛋白医用敷料”是否也会被纳入III类医疗器械管理目前尚不明确。
但是就目前的监管趋势来看,以成分进行分类的可能性不大。
伴随着对医美类医疗器械的管控越发细致与严格,会给原先“挂羊头卖狗肉”的厂家带来巨大的冲击与影响。与此同时,也将为消费者带来更为安全、有效的医用敷料产品。不合规的产品正在被逐步肃清,这个市场洗牌和重建也指日可待。
文章来源:医美行业观察
版权声明:转载医美医美行业观察的原创文章,需注明文章来源以及作者名称。公众号转载请联系开白小助手(微信号:pingshalaile)。违规转载法律必究。

扫描二维码,第一时间获取医美行业的资讯和动态。
从此和医美医美行业观察建立直接联系。
相关推荐
本栏目文字内容归ymguancha.com所有,任何单位及个人未经许可,不得擅自转载使用。
Copyright © 医美行业观察 | 京ICP备20027311号-1
参与评论