快讯
医美行业观察

医美行业合规新思考|“水光针”产品如何在监管中受益
导读:3月30日消息,国家药品监督管理局对外发布《关于调整《医疗器械分类目录》部分内容的公告(2022年第30号)》(以下简称《目录》),此次调整,关于“水光针”和射频仪器的变动引起了广泛关注,尤其是《目录》中明确注射用透明质酸钠溶液用于注射到真皮层,按照III类器械监管。
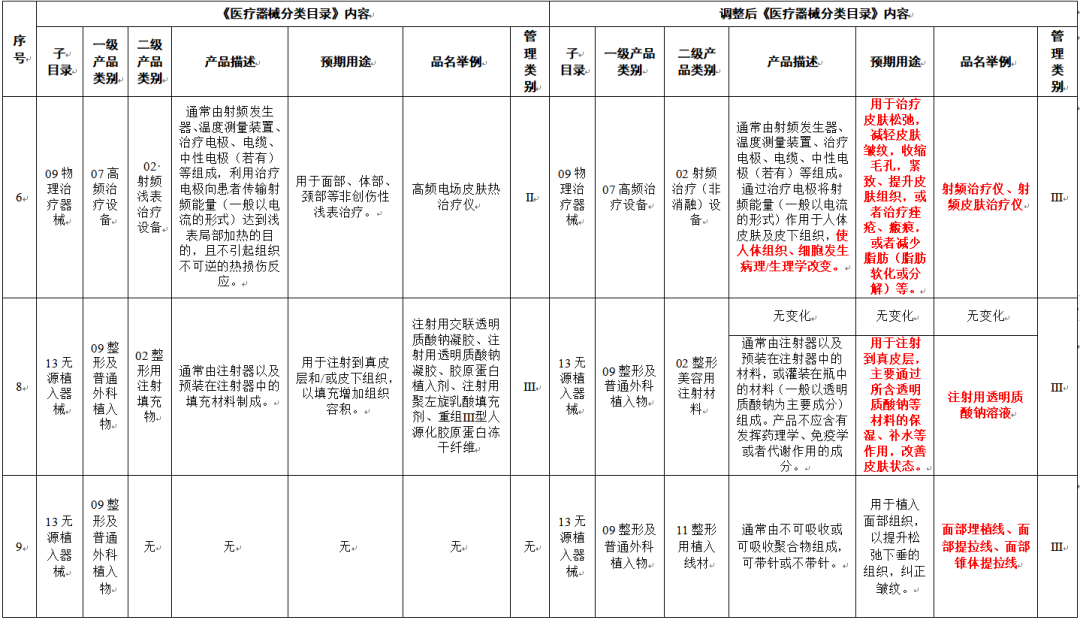
国家对医美行业的监管越来越细分,“水光针”纳入正规军意味着行业鱼龙混杂的局面将得到改善,也意味着高标准合规的医美医疗器械厂商将在此轮洗牌中胜出。“水光针”走向合规化,原料透明质酸钠也应合规化、标准化。
作者|梦哲
01行业合规加速推进,“水光针”原料要打好基础
在新规发布之前,市面上使用的“水光针”远比在药监局备案的产品数量多,或者获批适应症和实际使用有很大出入。随着新规的发布,“水光针”纳入III类器械监管,市面上的正规“水光针”只会越来越少。
纵观我国水光针市场,规模大且处于快速增长阶段,旺盛的消费需求和有限的产品供给形成强烈对比。从上游厂商角度看,水光针定位明确后,各大厂商将加速推进产品申报,力争早拿证推出产品,尽早享受到合规市场红利期;从医美机构的角度看,严监管下机构将进一步减少不合规产品使用,短期内将推动相关合规产品的采购需求。
按照官方解释,“水光针”通常是指以透明质酸钠为主要成分的一类复合溶液产品,通过注射至真皮层产生效果。所以对“水光针”的监管,某种意义上也是对透明质酸钠上游原料的监管。
众所周知,中国是透明质酸钠原料生产供给大国,中国企业经过层层“通关”,已经可以生产出高质量的透明质酸钠原料。但相反的是,目前中国的医美行业仍然是进口透明质酸钠品牌占据主导地位,国产品牌尚未显示出强大的竞争实力。
一款产品的市场份额一定是产品品质决定的。在所有产品的生产中,都有这样一点共识,“原料是基础,工艺是关键”。所以最终决定一款产品本质优劣的是原料,而工艺是负责进行创造的关键因素。
02从合规到高质,透明质酸钠原料要走几步
透明质酸钠的终端应用分为医药、化妆品和食品,医药级透明质酸钠对于质量控制最为严格,壁垒也最高。医药级产品市场可进一步细分为医疗美容、骨科治疗和眼科治疗三个领域,并且医疗美容领域的应用规模和增长速度上都高于骨科和眼科,所以医美领域的透明质酸钠原料是整个行业中品质要求最高、需求量最大、市场潜力最大的。
虽然中国是透明质酸钠供给大国,但是在国内拥有GMP证书的透明质酸钠生产企业只有两家,分别为众山生物和华熙生物。随着华熙生物在透明质酸钠终端产品线的不断拓展,企业也越来越朝着“生物科技全产业链平台型企业”发展。众山生物则一直在原料端钻研且拥有原料药登记号为A状态,是一家专研&只做玻璃酸钠原料的企业。
原料的合规是品牌合规的基础,原料的优劣也影响着产品的优劣。所以决定一款透明质酸钠原料足够优秀的两大因素:一是合规;二是高质。
从合规的角度来看,企业在生产医药级透明质酸钠时,需要经过 GMP(药品生产质量管理规范)的质量审核和稳定性考察,还需要药厂生产许可证、药品批准文号等,整个过程一般需要 2-5 年。世界卫生组织还将GMP定义为指导食物、药品、医疗产品生产和质量管理的法规。值得一提的是,取得药品GMP认证证书的企业(车间),在申请生产新药时,药品监督管理部门予以优先受理。所以有取得GMP认证的原料企业在新品获批上就占据了优势,据了解,众山生物是取得了这一认证资质的。
尤其是近期众山生物依据组织工程医疗器械产品透明质酸钠YY/T 1571-2017行业标准,推出了全新的产品系列MEDIHYA® I和MEDIHYA® S,可应用于Ⅱ、Ⅲ类医疗器械。
在行业内,YY/T 1571标准规定了用于外科植入物的组织工程医疗器械产品透明质酸钠的要求以及实验方法,适用于制备组织工程医疗器械产品及其支架材料的透明质酸钠。所以依据这项标准推出的产品是精准符合透明质酸钠专业要求的。

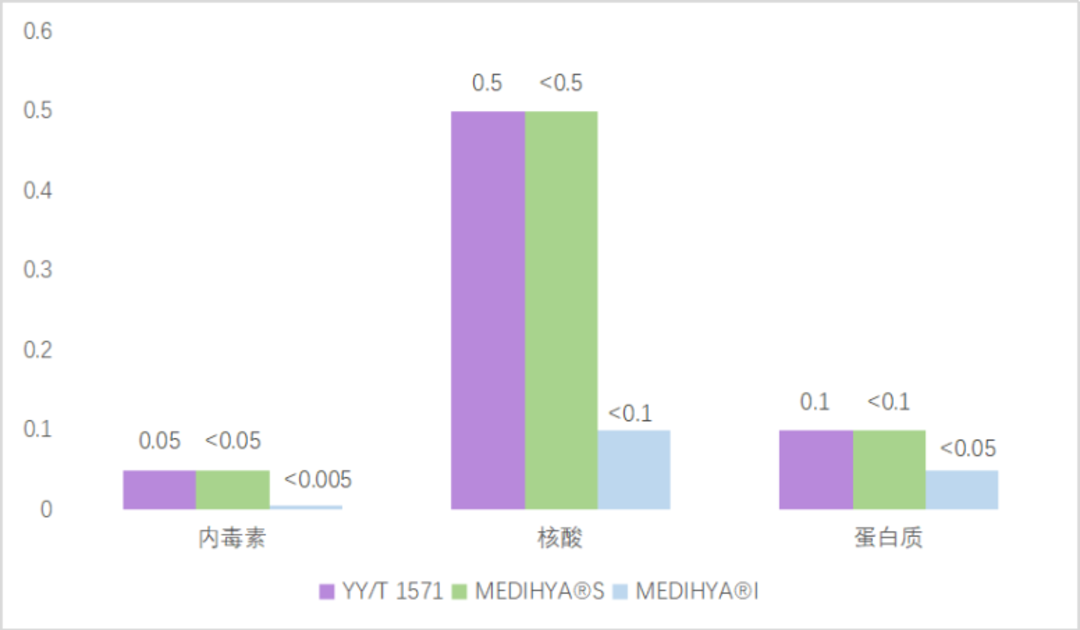
从原料质量上来看,影响甚至决定透明质酸钠质量优劣的两个重要指标是内毒素和微生物。内毒素是致热源物质,超标可引起人体发热、热循环障碍、内毒素休克及播散性血管内凝血等。生产工艺中增加相应步骤去除内毒素,工艺用水应为符合《欧洲药典》的纯化水。微生物要求<10 cfu,生产中通过控制pH、温度、乙醇用量、过滤、纯化等步骤控制微生物。
可以简单理解为内毒素和微生物含量越低,质量越高。其中众山生物旗下的MEDIHYA® I的核酸(< 0.1),内毒素(< 0.005 EU/mg)以及蛋白含量(< 0.05%)等均远远低于YY/T 1571标准限度,处于行业领先地位。
高质、合规的原料到一款优秀的产品品牌之间还横亘着一个运输难题。据《医疗器械监督管理条例》规定,对从事Ⅲ类医疗器械经营的企业,实行经营许可管理,经营单位需持有《医疗器械经营备案证》或《医疗器械经营许可证》,生产工艺、无菌保存等要求,也会远高于Ⅰ类和Ⅱ类医疗器械。
所以从原料生产完成到输送至上游厂商,技术把控也同样重要。众山生物深耕透明质酸钠原料多年,已经形成一整套完整的运输方案,温控体系能够保证运输过程温度适宜、产品安全有效。
在当下监管越来越严格和细分的情况下,尤其是关于“水光针”监管新规的施行,让行业几乎“无针可用”,产品不合规、品质差、超范围超剂量注射等现实问题给被注射者带来很大的安全隐患也一再触动行业和社会的神经。强监管或许短时间内难以让业内人适应,也让很多产品开始“不合规”,但是长期看,绝对是一个利好行业的举措。作为上游厂商现阶段能做的就是努力钻研产品,从原料到工艺,再到品牌宣传,都要达到合规合法,未来,品质优秀的产品将为企业赢得更多话语权。
如有读者希望对接“众山生物”
可直接拨打电话咨询:0532-80821290
于女士 13176866710

文章来源:医美产业笔记
版权声明:转载医美医美行业观察的原创文章,需注明文章来源以及作者名称。公众号转载请联系开白小助手(微信号:pingshalaile)。违规转载法律必究。

扫描二维码,第一时间获取医美行业的资讯和动态。
从此和医美医美行业观察建立直接联系。
相关推荐
本栏目文字内容归ymguancha.com所有,任何单位及个人未经许可,不得擅自转载使用。
Copyright © 医美行业观察 | 京ICP备20027311号-1
参与评论